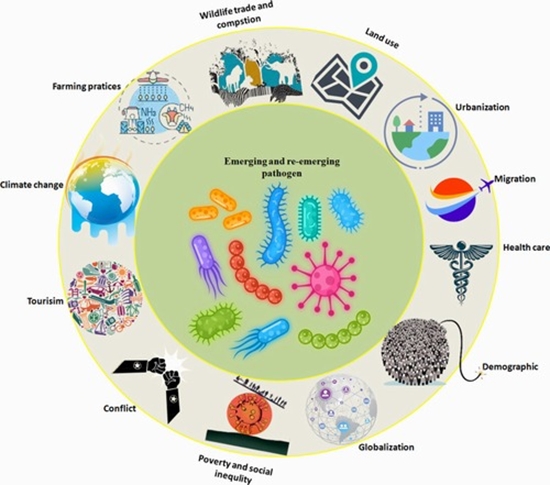
بیماریهای نوپدید و بازپدید
گزارش جامع بیماریهای نوپدید و بازپدید — وضعیت، تشخیص، رجیستری، درمان و پیگیری
تاریخ مرجع جمعآوری اطلاعات : تا 20 سپتامبر 2025
خلاصه اجرایی (Executive summary)
در هفتهها و ماههای اخیر، جهان شاهد بروز همزمان الگوهای متنوعی از بیماریهای عفونی بوده است. این موارد شامل:
- گردش مجدد سویههای2 SARS-CoV- مانند NB.1.8.1 در برخی نواحی
- گسترش بیماریهای ناقلپایه مانند دنگی، چیکونگونیا و وست نایل در آمریکای لاتین، اروپا و آسیا
- موارد نوپدید یا خوشهای Nipah در بنگلادش
- اپیدمیهای متمرکز ابولا در جمهوری دموکراتیک کنگو
- بار پایداری از بیماریهای بازپدید مانند تب کریمه-کنگو در برخی مناطق
پاسخ مؤثر به این چالشها مستلزم راهاندازی یک سامانه یکپارچه ملی متشکل از : تشخیص مولکولی و توالییابی سریع، پایش فاضلاب وsentinel، رجیستریهایmulti-pathogen با بیوبانک استاندارد و شبکه کلینیکهای میانرشتهای است.
SARS-CoV-2 و لانگ-کووید
- وضعیت اپیدمیولوژیک (واریانت غالب)
در اوایل سال ۲۰۲۵، واریانت واریانتNB.1.8.1 ملقب «Nimbus» با افزایش سهم در توالییابیهای جهانی ظهور کرد. این واریانت که توسط سازمان جهانی بهداشت (WHO) در رده "Variants Under Monitoring" (VUM) قرار گرفته، ابتدا در آسیا و سپس در سایر مناطق جهان شناسایی شد. اگرچه ارزیابی خطر کنونی آن در سطح کم تا متوسط باقی مانده، اما مطالعات برای ارزیابی دقیقتر پتانسیل فرار از ایمنی و تأثیر بر شدت بیماری ادامه دارد.
- تشخیص و پایش (Surveillance)
- تستهای RT-PCR و تستهای سریع آنتیژن پایه اصلی تشخیص بالینی هستند. اما برای ردیابی واریانتهای جدید و ارزیابی فرار ایمنی، استفاده از توالییابی ژنومی (NGS) و تستهای خنثی سازی (Neutralization Assays) ضروری است.
- به کارگیری پایش فاضلاب (Wastewater-Based Surveillance - WBS) و نظام مراقبت sentinel برای هشدار زودهنگام و ردیابی الگوی گردش ویروس در سطح منطقهای توصیه میشود.
- رجیستری و نمونهبرداری (Registry & Bio banking)
ایجاد یک رجیستری ملی با فیلدهای کلیدی زیر پیشنهاد میشود:
- اطلاعات پایه و شناسه یکتا
- دادههای بالینی شامل تاریخ شروع علائم، مقدار CT در PCRو comorbidities
- سابقه واکسیناسیون (نوع و تاریخ واکسنها)
- دادههای ژنومی (توالی ویروس به همراه متادیتای کامل)
- نمونههای بیوبانک (شامل سرم، پلاسما، خون کامل و سواب تنفسی با استانداردهای نگهداری در دمای مناسب)
- نتایج گزارش شده توسط بیمار (PROs) برای لانگ کووید (مانند مقیاسهای خستگی و معیارهای شناختی)
لازم است استانداردهای دقیقی برای نگهداری نمونهها و همچنین ایجاد پیوند یکپارچه بین این دادهها و شبکههای ملی مبتنی بر متادیتا تعریف شود.
- درمان و پیگیری
- واکسیناسیون و تزریق دوزهای یادآور، مؤثرترین راه برای پیشگیری از شکل شدید بیماری هستند. درمانهای ضدویروسی و مداخلات حمایتی باید مطابق با آخرین راهنمای ملی و دستورالعملهای WHO انجام پذیرد.
- مدیریت این بیماران نیازمند رویکردهای چندرشتهای و برنامههای توانبخشی است
- ثبت دادههای واقعی (Real-World Evidence - RWE) در رجیستری برای طراحی و پشتیبانی از کارآزماییهای بالینی آینده حیاتی است.
- توصیههایی برای نظام سلامت ایران
- تقویت و توسعه ظرفیت توالییابی ژنومی در سطح کشور (با ایجاد ۲ تا ۳ آزمایشگاه مرجع مجهز).
انفلوانزای فصلی و آنفلوانزای پرندگان (A(H5Nx), H7)
- وضعیت اپیدمیولوژیک
موارد آنفلوانزای فصلی (H1N1, H3N2) در نواحی مختلف نوسان فصلی دارند؛ آنفلوانزای پرندگان (H5N1/H5Nx) بر اساس آمار تجمعی و گزارشهای موقت سازمان جهانی بهداشت (تا تاریخ ۲۵ اوت ۲۰۲۵)، موارد انسانی عفونت با ویروسهای H5 همچنان در برخی کشورها گزارش میشود. این موضوع لزوم پایش مستمر و هوشیاری اپیدمیولوژیک را برای شناسایی بهموقع هرگونه تغییر در الگوی بیماریزایی و سرایت آن تأکید میکند.
- تشخیص و آزمایشگاه
- انجام تست PCR برای تایپ و سابتایپ کردن ویروس و همچنین توالییابی ژنومی برای شناسایی کلادهای در گردش، ضروری است.
- استفاده از تست سریع آنتیژن (Rapid Antigen Test) میتواند برای مدیریت بالینی فوری در نقطه ارائه خدمت (Point-of-Care) مفید باشد.
- ارسال نمونهموارد مشکوک به آنفلوانزای پرندگان با پتانسیل بیماریزایی بالا (HPAI)، بهآزمایشگاههای مرجع ملی برای تأیید نهایی و انجام آزمایشهای تخصصی الزامی است.
- ثبت اطلاعات و نمونهبرداری
- ثبت دقیق و تفکیکشده تمامی موارد انسانی آنفلوانزای پرندگان (HPAI) در یک سامانه ملی ضروری است.
- از بیماران باید نمونههای تنفسی (مانند سواب بینی-حلقی)، نمونههای سرمی (برای مطالعات سرولوژی و پایش آنتیبادی) و نمونههای مناسب برای توالییابی کامل ژنوم ویروس جمعآوری شود.
- ذخیرهسازی مناسب نمونهها برای ارزیابیهای آینده از قبیل بررسی آنتیبادیهای خنثیکننده متقاطع (Cross-Neutralization) و ارزیابی خطر سازگاری ویروس با میزبان انسانی (Zoonotic Adaptation) توصیه میشود.
- درمان و پیگیری
- تجویز سریع داروهای ضدویروسی اختصاصی مانند Oseltamivir و Zanamivir در اولین فرصت پس از شروع علائم (پنجره درمانی طلایی) بسیار حیاتی است.
- بیمارانی که دوره شدید بیماری را پشت سر گذاشتهاند، باید از نظر بروز عوارض دیررس، بهویژه عوارض ریوی، تحت پایش و پیگیری منظم قرار گیرند.
- رعایت دقیق پروتکلهای پیشگیرانه و استفاده از تجهیزات حفاظت فردی (PPE) برای کارکنان صنایع طیور و تمامی افرادی که در معرض تماس با پرندگان یا محیط آلوده هستند، اکیداً توصیه میشود.
- توصیههای راهبردی برای نظام سلامت ایران
- ایجاد و تقویت یک شبکه ملی گزارشدهی سریع برای موارد انسانی و دامی و هماهنگی مستمر با سازمان دامپزشکی کشور.
- آمادهسازی و استانداردسازی روند جمعآوری، نگهداری و ارسال نمونهها به آزمایشگاه های مرجع در کوتاهترین زمان ممکن.
- در نظرگیری برنامه واکسیناسیون پیشگیرانه دامها و طیور در کانونها و مناطق پرخطر، مطابق با سیاستهای ملی کنترل بیماری و در صورت دسترسی به واکسن مناسب.
Arboviruses: Dengue, Chikungunya, Zika, West Nile
این گروه یکی از بحرانیترین مجموعهها برای 2025 است؛ گسترش ناقلان و تغییر اقلیم آنها را در نواحی تازهورود افزایش داشته است.
Dengue
- وضعیت اپیدمیولوژیک جهانی
Region of the Americas (PAHO) : حجم بالایی از موارد (میلیونها مظنون و صدها هزار تأیید) در 2024–2025؛ اما در تابستان 2025 در برخی کشورها روند کاهشی نسبت به 2024 ثبت شده است (گزارش PAHO EW35 2025. ) در کشورهای جنوبشرق آسیا و اقیانوسیه نیز موارد فصلی مشاهده شدهاند.
- تشخیص
- تست مولکولی ( (PCRدر فاز ویرمی (5 روز اول بیماری) برای تشخیص مستقیم ویروس و تعیین سروتیپ آن، روشی بهصرفه و دقیق محسوب میشود.
- از روز پنجم تا هفتم بیماری به بعد، تستهای سرولوژی برای شناسایی آنتیبادیهای IgM )عفونت اولیه) و IgG )عفونت گذشته یا ثانویه) کاربرد دارند.
- تست تخصصی خنثیسازیPRNT) (Plaque Reduction Neutralization Test, به عنوان استاندارد طلایی برای تمایز بین سروتیپهای مختلف ویروس دنگی و نیز تمایز آن از دیگر ویروسهای همخانواده (مثل زیکا) و همچنین برای ارزیابی دقیق سطح آنتیبادیهای خنثیکننده استفاده میشود.
- ثبت موارد و نمونهبرداری
- ثبت کامل و دقیق تمامی موارد شدید بیماری، شامل تب هموراژیک دنگی (DHF) و سندرم شوک دنگی (DSS)، در یک سامانه ملی ضروری است.
- جمعآوری نمونههای سرمی به صورت سریال (پیاپی) از بیماران برای مدلسازی سیر پاسخ ایمنی و پایش تغییرات آنتیبادی توصیه میگردد.
- بانکسازی و ذخیرهسازی مناسب نمونهها برای استفاده در مطالعات آینده در حوزههای ویروسشناسی، ایمنیشناسی و ارزیابی کارآیی واکسنها امری حیاتی است.
- راهکارهای درمان و کنترل
- اساس درمان بر مدیریت حمایتی، بهویژه جبران مایعات بدن و پایش دقیق نشانگرهای همودینامیک استوار است.
- کنترل ناقل: اجرای مستمر و قوی برنامههای کنترل ناقلین پشه Aedes با روشهای سنتی (مانند سمپاشی و حذف محلهای تخمریزی) و همچنین به کارگیری روشهای نوین مانند رهاسازی پشههای آلوده به باکتری Wolbachia در قالب پروژههای بزرگ و مطالعهشده، برای شکستن زنجیره انتقال بیماری ضروری میباشد.
- توصیههای راهبردی به نظام سلامت ایران
- تقویت برنامههای جامع و مستمر کنترل پشه ناقل Aedes، بهویژه در مناطق شهری پرجمعیت و نقاط بحرانی.
- آمادهسازی و راهاندازی یک سامانه ملی گزارشدهی و پایش (Surveillance) موارد شدید دنگی برای شناسایی و پاسخ بهموقع به طغیانهای احتمالی.
- افزودن فیلدهای اختصاصی مربوط به شدت بیماری دنگی به رجیستری ملی بیوبانک جهت تسهیل تحقیقات اپیدمیولوژیک و کلینیکی بر روی نمونههای ذخیرهشده.
Chikungunya
- وضعیت اپیدمیولوژیک جهانی (سال 2025):
- در سال 2025، جهان شاهد بروز خوشهها و اپیدمیهای بزرگ چیکونگونیا در آمریکای جنوبی (به ویژه در کشورهای بولیوی، برزیل و پاراگوئه) و منطقه کارائیب بوده است.
- علاوه بر این، موارد انتقال بومی (Autochthonous) این بیماری در اروپا نیز افزایش یافته است.
- ژنوتایپهای در گردش غالب، ECSA و Asian هستند.
- راهکارهای تشخیصی:
- روش تشخیص بهینه در روزهای اولیه بیماری (فاز حاد)، تست PCR است.
- پس از روز پنجم بیماری، روشهای سرولوژی مانند تست الایزا برای شناسایی آنتیبادیهای IgM/IgG روش مناسبتری هستند.
- انجام تشخیص افتراقی با بیماری دنگی (Dengue) به دلیل شباهت علائم بالینی و مناطق جغرافیایی مشترک، بسیار حائز اهمیت است.
- ثبت دادهها و نمونهبرداری:
- جمعآوری نمونه سرم از بیماران ضروری است. این نمونهها باید برای مطالعات آتی در زمینه پاتوژنز، به ویژه مکانیسمهای منجر شونده به آرتروپاتی مزمن، ذخیره شوند.
- ایجاد یا تقویت سیستم ثبت ملی (رجیستری) برای ثبت موارد بیماری حیاتی است. این سیستم باید شامل فیلدهای دقیقی برای ثبت مدت زمان و شدت درد مفاصل (Patient-Reported Outcomes - PROs) باشد.
- درمان و پیگیری:
- درمان در فاز حاد عمدتاً حمایتی است (شامل استراحت، هیدراتاسیون و داروهای ضدالتهاب غیراستروئیدی).
- مدیریت درد مزمن مفصلی (آرترالژی پس از چیکونگونیا) یک رکن اصلی مراقبتهای بلندمدت است.
- ضروری است بیماران برای عوارض مزمن به ویژه آرتروپاتی، تحت پیگیریهای بلندمدت منظم قرار گیرند.
- توصیههای راهبردی برای نظام سلامت ایران:
- تقویت سیستم پایش و نظارت بر حشره ناقل (Aedes spp.) و بیماریهای منتقله توسط آن.
- تجهیز آزمایشگاههای مرجع برای انجام دقیق تشخیص تفکیکی چیکونگونیا از دنگی و سایر آرتروویروسها.
- افزودن فیلدهای اختصاصی مانند مدت زمان آرترالژی و پاسخ به درمانهای مختلف به فرمهای ثبت موجود برای جمعآوری دادههای باکیفیت.
- تدوین پروتکلهای ملی برای مدیریت و پیگیری بیماران با عوارض مفصلی طولانیمدت چیکونگونیا.
West Nile Virus (WNV)
- وضعیت اپیدمیولوژیک در اروپا (تابستان ۲۰۲۵):
در تابستان سال ۲۰۲۵، چندین کشور اروپایی شاهد بروز خوشههایی از عفونت ویروس نیل غربی (WNV) بودند. کشورهای ایتالیا و یونان بیشترین تعداد موارد را گزارش کردند. بر اساس آمار منتشر شده تا اوایل سپتامبر ۲۰۲۵، تعداد موارد ثبتشده محلی در اروپا از مرز ۶۰۰ مورد عبور کرد که سهم قابل توجهی (حدود ۵۰۰ مورد) مربوط به ایتالیا بود.
- راهکارهای تشخیصی:
- تشخیص مولکولی (PCR) از نمونههای سرم یا مایع مغزی-نخاعی (CSF) در مراحل اولیه عفونت استفاده میشود.
- تشخیص سرولوژیک آنتیبادیهای IgM خاص ضد ویروس در سرم یا CSF روشی استاندارد برای تأیید تشخیص است.
- تشخیص قطعی عفونت عصبی (نورواینویژن) مستلزم ارزیابی دقیق عصبی (نورولوژیک) و استفاده از مطالعات تصویربرداری مانند (MRI) است.
- ثبت دادهها و نمونهبرداری:
- ایجاد یک سیستم ثبت (رجیستری) برایمانیتور کردن موارد مبتلا به عوارض عصبی و فلج ناشی از ویروس ضروری است.
- جمعآوری و ذخیرهسازی نمونههای سرم و CSF از بیماران برای اهداف تشخیصی و تحقیقاتی آینده توصیه میشود.
- اجرای برنامههای پیگیری بلندمدت برای پایش عواقب و بهبودی علائم عصبی در بازماندگان بیماری حیاتی است.
- درمان و پیگیری بالینی:
در حال حاضر درمان اختصاصی ضدویروسی برای WNV وجود ندارد و اساس مراقبتهای بالینی بر درمان حمایتی استوار است. با این حال، پیگیری منظم بیماران برای ارزیابی عواقب عصبی بلندمدت و ارائه خدمات توانبخشی(فیزیوتراپی، کاردرمانی) یک بخش ضروری از فرآیند درمان محسوب میشود.
- توصیههای راهبردی برای نظام سلامت ایران:
- تقویت و توسعه برنامههای پایش فعال در جمعیت پرندگان به عنوان میزبان پشههای ناقل (کولکس) در مناطق پرخطر
- اجرای برنامههای منظم نظارت محیط زیستی و کنترل زیستگاههای تکثیر پشهها در مناطق شهری و روستایی.
- تجهیز آزمایشگاههای مرجع ملی و منطقهای با ابزارها و پروتکلهای لازم برای تشخیص دقیق و بههنگام موارد عفونت عصبی ناشی از WNV و سایر آربوویروسها.
- آموزش پزشکان و کارکنان بهداشتی در مناطق در معرض خطر برای شناسایی و گزارش علائم بالینی مشکوک به انسفالیت ویروسی.
Mpox (Monkeypox)
- وضعیت جهانی (تا سپتامبر ۲۰۲۵):
اپیدمی جهانی آبله میمونی (Mpox) که در بازه زمانی ۲۰۲۲ تا ۲۰۲۴ رخ داد، به تدریج تحت کنترل درآمد. با این حال، بروز خوشههای فعال بیماری در برخی مناطق، به ویژه در جمهوری دموکراتیک کنگو (DRC) در آفریقای مرکزی، در طول سالهای ۲۰۲۴ و ۲۰۲۵ ادامه یافته است. سازمان جهانی بهداشت (WHO) با انتشار مستمر گزارشهای وضعیت (Situation Reports)، روند جهانی بیماری را پایش کرده است. این سازمان در سپتامبر ۲۰۲۵، وضعیت اضطراری بهداشت عمومی با اهمیت بینالمللی (PHEIC) را برای موج اخیر بیماری لغو کرد، اما بر ضرورت تداوم نظام مراقبت و نظارت فعال در سطح جهانی تأکید دارد.
- راهکارهای تشخیصی:
- تست تشخیصی PCRاز نمونههای گرفته شده از ضایعات پوستی، روش استاندارد طلایی برای تأیید تشخیص است.
- انجام توالییابی ژنومی (Genomic Sequencing) روی نمونههای مثبت برای ردیابی گردش کلادها (Clades) مختلف ویروس و بررسی شیوع گونههای جدید و جهشیافته ضروری است.
- ثبت دادهها و نمونهبرداری:
- ایجاد و نگهداری یک سیستم ثبت ملی (رجیستری) برای ثبت دقیق همه موارد مثبت و مشکوک) به منظور ردیابی اپیدمیولوژیک بیماری حیاتی است.
- جمعآوری نمونههای مناسب (از جمله نمونههای پوستی از ضایعات و نمونههای سرم) برای اهداف تشخیصی، ارزیابی پاسخ ایمنی میزبان و ذخیرهسازی در بانک نمونه برای مطالعات آتی توصیه میشود.
- درمان و پیگیری بالینی:
- اگرچه بیماری در بسیاری از موارد خودمحدودشونده است، اما داروی ضدویروسی tecovirimat برای درمان موارد شدید، افراد با نقص سیستم ایمنی و گروههای پرخطر تجویز میشود.
- پیگیری طولانیمدت بیماران برای پایش و مدیریت عوارض پوستی (مانند اسکار و هیپوپیگمانتاسیون) و همچنین ارزیابی و رسیدگی به عوارض روانپزشکی(مانند اضطراب و افسردگی) ناشی از بیماری بسیار مهم است.
- توصیههای راهبردی برای نظام سلامت ایران:
- آمادهسازی و انتشار الگوریتم تشخیصی استاندارد برای شناسایی و ارزیابی ضایعات پوستی مشکوک به آبله میمونی در مراکز بهداشتی و درمانی سراسر کشور.
- تعریف یک مسیر گزارشدهی شفاف و اجباری از سطوح اولیه ارائه خدمت تا مراکز مرجع و ملی برای اطمینان از گزارش بههنگام موارد.
- توسعه دستورالعملهای دقیق برای ایزوله و قرنطینه موارد مثبت و مشکوک در مراکز تعیینشده، با در نظر گرفتن ملاحظات اخلاقی و رفاه بیمار.
- تضمین در دسترس بودن کیتهای تشخیصی معتبر (PCR) و داروهای مورد نیاز مانند tecovirimat در مراکز مرجع و آموزش تیمهای درمانی برای مدیریت بالینی بیماری به افزایش سطح آمادگی نظام سلامت منجر میگردد.
Nipah (NiV)
- وضعیت اپیدمیولوژیک (بنگلادش، ۲۰۲۵)
تا تاریخ ۲۹ اوت ۲۰۲۵، بنگلادش چهار مورد تأییدشده از عفونت ویروس نیپا را همراه با چهار مورد فوتی گزارش کرده است. موارد گزارش شده پراکنده و فاقد پیوند اپیدمیولوژیک واضح هستند. سازمان جهانی بهداشت (WHO) و شرکای محلی در حال انجام ردیابی تماس و اقدامات کنترل برای مهار شیوع هستند. در این منطقه، ویروس نیپا یک تهدید بهداشتی فصلی شناخته میشود.
- روشهای تشخیصی
- تست RT-PCR بر روی نمونههای خون، مایع مغزی-نخاعی (CSF)، swabگلو یا بافت روش استاندارد است.
- آزمایشهای سرولوژیک مانند ELISA برای بررسی آنتیبادی و مطالعات اپیدمیولوژیک در موارد بعدی کاربرد دارند.
- شناسایی به موقع و ایزوله کردن بیماران به دلیل خطر انتقال ویروس از انسان به انسان، امری حیاتی است.
- ثبت موارد و جمعآوری نمونه
- ایجاد یک سامانه ثبت برای تمام موارد مشکوک و تأییدشده همراه با مستندسازی دقیق تماسهای بیماران و سابقه تماس با حیوانات ضروری است.
- جمعآوری نمونههای زیستی (بهویژه در موارد خوشهای یا خانوادگی) برای تعیین توالی ژنومی ویروس و بررسی منشاء شیوع توصیه میشود.
- گزینههای درمانی و پیگیری
- در حال حاضر هیچ درمان ضدویروس اختصاصی وجود ندارد و مراقبتهای حمایتی پایه اصلی درمان را تشکیل میدهند.
- چندین واکسن از جمله طرحهای تحت حمایت CEPI در مرحله کارآزمایی بالینی هستند و تحقیقات برای آمادهسازی آزمایشهای انسانی در بنگلادش در جریان است.
- بازماندگان بیماری باید از نظر عوارض عصبی احتمالی و ناتوانیهای طولانیمدت تحت نظر و پیگیری قرار گیرند.
- توصیههای کلیدی برای نظام سلامت ایران
- هوشیاری نظام مراقبت بهداشتی در مناطقی که دارای تجارت بینالمللی حیوانات هستند یا پروازهای مستقیم از جنوب آسیا (بهویژه بنگلادش) را دریافت میکنند، افزایش یابد.
- اطمینان از در دسترس بودن و توانایی انجام تست RT-PCR اختصاصی برای ویروس نیپا در آزمایشگاههای مرجع ملی.
- توسعه و اجرای پروتکلهای استاندارد و الگوریتمهای سریع برای ردیابی تماسهای بیماران مشکوک به نیپا.
افزایش آگاهی پزشکان و کارکنان بهداشتی در مورد علائم بالینی، راههای انتقال و پروتکلهای کنترل عفونت برای ویروس نیپا.
تب کریمه-کنگو (CCHF) — تمرکز خاص برای ایران
- وضعیت اپیدمیولوژیک
ایران از جمله کشورهای اندمیک برای بیماری تب کریمه-کنگو محسوب میشود. استانهایی با فعالیت کشاورزی و دامپروری بالا، بهویژه سیستان و بلوچستان، خراسان، اصفهان، فارس و خوزستان، بیشترین میزان بروز بیماری را به خود اختصاص دادهاند. بر اساس گزارشهای اخیر و مطالعات تکمیلی، سالانه تعداد قابلتوجهی مورد ثابت از این بیماری در کشور ثبت میشود که لزوم توجه و تقویت نظام مراقبت را بیش از پیش نشان میدهد.
- روشهای تشخیص
- تست PCR بر روی نمونه خون بیمار.
- سرولوژی (آزمایش آنتیبادی) برای شناسایی IgM عفونت حاد و IgG عفونت مزمن.
- دسترسی سریع و گسترده به این کیتهای تشخیصی در آزمایشگاههای مرجع، بهویژه در مناطق پرخطر، برای تشخیص بهموقع و آغاز درمان و همچنین اجرای پروتکلهای کنترل عفونت ضروری است.
- ثبت موارد و مدیریت نمونه
- ایجاد و نگهداری یک رجیستری (ثبت) ملی جداگانه برای تمامی موارد مشکوک و قطعی CCHF در وزارت بهداشت.
- تدوین روشهای اجرایی استاندارد (SOP) برای نمونهبرداری، انتقال و ذخیرهسازی ایمن نمونهها با رعایت کامل پروتکلهای ایمنی زیستی.
- نمونههای خون کامل و پلاسما باید با مستندسازی کامل شامل تاریخ نمونهگیری، اطلاعات اپیدمیولوژیک (مانند سابقه تماس با دام یا گزش کنه) و تاریخ کشت، ذخیره شوند.
- رویکردهای درمانی و پیگیری
- اساس درمان بر مراقبتهای حمایتی متمرکز است (جایگزینی مایعات و الکترولیتها، مدیریت خونریزی و پشتیبانی از اعضای حیاتی).
- استفاده از داروی ریباویرین در پروتکلهای درمانی برخی مراکز، بهویژه برای موارد شدید، رایج است.
- برای بیمارانی که دوره حاد بیماری را پشت سر میگذارند، پیگیری طولانیمدت عملکرد کلیه و کبد به دلیل احتمال بروز عوارض دیررس ضروری است.
- توصیههای راهبردی به نظام سلامت ایران
- آموزش و پیشگیری:
- اجرای برنامههای آموزشی مستمر برای گروههای پرخطر (کشاورزان، دامداران، کارگران کشتارگاهها) در مورد routes انتقال و روشهای پیشگیری.
- تامین و ترویج استفاده از وسایل حفاظت فردی (PPE) مناسب در مشاغل مرتبط با دام.
- تقویت زیرساختهای تشخیصی:
- تجهیز و تقویت آزمایشگاههای منطقهای در استانهای پرخطر برای انجام تستهای سریع و دقیق.
- کنترل عفونت در مراکز درمانی:
- تدوین و اجرای سختگیرانه پروتکلهای کنترل عفونت در بیمارستانها برای جلوگیری از انتقال nosocomial اکتسابی از بیمارستان که یکی از راه های مهم انتقال محسوب میشود.
- ایجاد سامانه یکپارچه نظارتی:
- تقویت و بهروزرسانی رجیستری متمرکز در وزارت بهداشت برای پایش دقیق اپیدمیولوژیک بیماری، ردیابی تماسها و اتخاذ تصمیمات بهموقع در مواجهه با طغیانها.
Ebola
- . وضعیت اپیدمیولوژیک جهانی
- در سپتامبر ۲۰۲۴، جمهوری دموکراتیک کنگو وقوع یک اپیدمی جدید ابولا را اعلام کرد.
- پاسخهای بهداشتی شامل واکسیناسیون حلقهای به سرعت آغاز شده است.
- با وجود پیشرفتها، شیوع متناوب ابولا در مناطق آفریقایی نشاندهنده نیاز مداوم و حیاتی به ظرفیت برای پاسخ سریع و هماهنگ در سطح جهانی است.
- روشهای تشخیص و مدیریت
- تشخیص قطعی توسط تستهای RT-PCR و GeneXpert در آزمایشگاههای مرجع با سطح ایمنی زیستی (BSL-4) انجام میشود.
- مدیریت موارد مشکوک و قطعی باید با رعایت شدید پروتکلهای ایزولاسیون و قرنطینه و با استفاده کامل از وسایل حفاظت فردی (PPE) توسط کلیه کارکنان بهداشتی-درمانی صورت پذیرد تا از انتقال ثانویه جلوگیری شود.
- ثبت موارد و مدیریت نمونهها
- رعایت استانداردهای سختگیرانه ایمنی زیستی برای نمونهبرداری، انتقال، ذخیرهسازی و حملونقل نمونهها الزامی است.
- ثبت دقیق و جزئیات تمامی تماسهای بیماران و همچنین ثبت سریال نمونههای جمعآوریشده برای ردیابی و پیگیری اپیدمیولوژیک ضروری میباشد.
- رویکردهای درمانی و پیگیری
- واکسیناسیون حلقهای با واکسن اِروبو (Ervebo) یک ابزار کلیدی در کنترل شیوع است.
- درمان شامل مراقبتهای حمایتی جامع (حفظ آب و الکترولیت، مدیریت عوارض) و در صورت دسترسی، استفاده از روشهای درمانی خاص مانند آنتیبادیهای مونوکلونال (در برخی سناریوها) است.
- پیگیری طولانیمدت بازماندگان ابولا برای پایش و مدیریت عوارض دیررس، بهویژه عوارض کلیوی و عصبی، توصیه میشود.
- توصیههای راهبردی به نظام سلامت ایران
اگرچه خطر ورود و شیوع ابولا در ایران در حال حاضر پایین ارزیابی میشود، اما حفظ و تقویت آمادگی ملی ضروری است:
- تدوین پروتکلهای آمادگی و پاسخ: ایجاد پروتکلهای شفاف برای غربالگری مسافران، مدیریت موارد مشکوک در points of entry و هماهنگی بینبخشی.
- تقویت توان تشخیصی: تضمین دسترسی آزمایشگاههای مرجع ملی به کیتهای تشخیصی معتبر و حفظ توانایی انجام تستهای ایمن.
- ایجاد ذخایر استراتژیک: نگهداری و بازچرخش ذخیره کافی از وسایل حفاظت فردی (PPE) و تجهیزات لازم برای کادر درمان.
- برنامهریزی برای واکسیناسیون: تهیه یک برنامه عملیاتی برای اجرای واکسیناسیون حلقهای در صورت شناسایی یک مورد، در هماهنگی کامل با دستورالعملهای سازمان جهانی بهداشت (WHO).
گردش مجدد پولیو (cVDPV) و افزایش موارد سرخک
حفظ پوشش MMR در کودکان، تقویت surveillance محیطی (سرویسهای فاضلاب) و آمادگی برای پاسخ واکسیناسیون منطقهای.
- وضعیت جهانی و نگرانیهای فعلی
- پولیو (فلج اطفال) : شناسایی ویروس پولیو مشتق از واکسن (cVDPV) در نمونههای محیطی و انسانی در چندین کانون، نگرانیهای جدی را برانگیخته است. به عنوان مثال، نوع cVDPV1 در اسرائیل و انواع cVDPV2 و cVDPV3 در سایر مناطق جهان گزارش شدهاند. این یافتهها حاکی از پوشش واکسیناسیون ناکافی در برخی جوامع است.
- سرخک : همزمان، شاهد افزایش چشمگیر موارد سرخک در منطقه قاره آمریکا (PAHO) هستیم که حداقل ده کشور را درگیر کرده است.
- پاسخ جهانی: در پاسخ به این رویدادها، برنامههای واکسیناسیون واکنشی (Response Vaccination) و پایش فعال در بسیاری از این مناطق در حال اجراست.
- راهبردهای تشخیص و پایش
برای پولیو:
-
- تقویت پایش محیطی (sampling switch) از طریق نمونهبرداری منظم از منابع آب و فاضلاب به عنوان یک سیستم هشدار اولیه ضروری است.
- گزارش فوری و بررسی همه موارد فلج حاد شل (AFP) برای ردگیری سریع هرگونه گردش ویروس الزامی است.
برای سرخک:
-
- تأیید آزمایشگاهی موارد مشکوک با استفاده از RT-PCR و سرولوژی (شناسایی IgM) حیاتی است.
- حفظ و تقویت شبکه ملی گزارشدهی و بررسی موارد سرخک برای شناسایی بهموقع زنجیرههای انتقال مورد نیاز میباشد.
- توصیههای راهبردی به نظام سلامت ایران
با توجه به وضعیت جهانی، حفظ آمادگی و پیشگیری در ایران از اولویت بالایی برخوردار است:
- حفظ ایمنی جمعیتی:
- تضمین پوشش واکسیناسیون حداکثری (>95%) با واکسن سهگانه MMR(سرخک، سرخجه، اوریون) و واکسن پولیو (IPV/OPV) در سطح کشور، به ویژه در مناطق مرزی و جمعیتهای آسیبپذیر.
- تقویت نظام پایش :
- ادامه و توسعه برنامه پایش محیطی پولیو از طریق نمونهبرداری از ایستگاههای فاضلاب در شهرهای بزرگ و پرخطر به عنوان یک سیستم هشدار پیشازوقوع.
- حساسسازی نظام مراقبت بهداشتی برای گزارش و بررسی فوری هر مورد مشکوک به AFP یا سرخک.
- آمادگی برای پاسخ سریع:
- داشتن طرح عملیاتی آماده برای اجرای کمپینهای واکسیناسیون واکنشی (موضعی یا منطقهای) در صورت شناسایی حتی یک مورد قطعی، برای قطع زنجیره انتقال در اسرع وقت.
تشخیص پیشرفته، پایش محیطی و فناوریهای نوین (Cross-cutting)
- پایش مبتنی بر فاضلاب (Wastewater-Based Surveillance - WBS)
- WBS به عنوان یک سازوکار مؤثر، غیرتهاجمی و هشداردهنده زودهنگام برای ردیابی گردش ویروسهایی مانند SARS-CoV-2، آنفلوآنزا و برخی آربوویروسها در سطح جامعه به اثبات رسیده است.
- کلید بهره برداری حداکثری از این فناوری، تدوین پروتکلهای استاندارد ملی برای نمونهگیری، انتقال نمونه و همچنین ایجاد یک خط پردازش تحلیلی (Analytical Pipeline) یکپارچه و کنترلکیفیتشده است.
- توالییابی نسل جدید (NGS) و متاژنومیکس
- فناوریهایNGS و متاژنومیکس توانایی شناسایی همزمان و بدون سوءگیری (Unbiased Detection) طیف وسیعی از پاتوژنهای شناختهشده و نوپدید را فراهم میکنند.
- اجرای موفق این فناوری مستلزم سرمایهگذاری کلان در زیرساختهای بیوانفورماتیک و تربیت نیروی انسانی متخصص است. هدف نهایی، کاهش زمان گزارش از نمونه تا نتیجه به کمتر از ۱۴ روز برای تبدیل دادههای خام به اطلاعات قابل اقدام در حوزه سلامت عمومی است.
- پنلهای چندگانه (Multiplex) و تشخیص در نقطه ارائه خدمت (Point-of-Care)
- توسعه و به کارگیری پنلهای مولتیپلکس PCR که قادر به تشخیص همزمان چندین پاتوژن با علائم بالینی مشترک (مانند سندرم های تنفسی یا اسهالی) هستند، دقت و سرعت تشخیص را به طور چشمگیری افزایش میدهد.
استفاده از دستگاههای مولکولی قابل حمل (Molecular Cartridges) در نقطه ارائه خدمت (POC) امکان تشخیص سریع و دقیق را در سطوح اولیه نظام سلامت (مانند مراکز بهداشتی درمانی) فراهم کرده و به مدیریت بهموقع بیماران و کنترل انتقال بیماری کمک شایانی میکند.
منابع کلیدی و پیوندهای عملی
(WHO — COVID-19 Global Situation / NB.1.8.1 (DON 2025-D572). World Health Organization
WHO — Cumulative human cases A(H5N1) (25 Aug 2025). World Health Organization
PAHO — Dengue epidemiological situation (EW35 2025). Pan American Health Organization
WHO — Mpox situation reports (situation report #58 Sep 2025). World Health Organization
WHO — Nipah (Bangladesh DON 2025-D582). World Health Organization
ECDC / PubMed — West Nile surveillance Europe 2025. ECDC+1
WHO EMRO / PubMed — Crimean-Congo Hemorrhagic Fever in Iran. World Health Organization+1
WHO / CDC — Ebola DRC 2025 situational updates. World Health Organization+1
WHO / GPEI — Polio (cVDPV updates 2025). World Health Organization+1
WHO GLASS / Lancet / ECDC / CDC — AMR & Candida auris updates. World Health Organization+2The Lancet+2
ISBER best practices (biobanking) و RECOVER/ISARIC protocol resources (for registry/PROs). Global Biodefense+1


_1.jpg)
ارسال نظر